kjemi
Støkiometriets lover beskriver sammensetningen av de forskjellige stoffene, basert på forholdene (i masse) mellom hver art som intervenerer i reaksjonen. Alt eksisterende saken er dannet av kombinasjonen, i forskjellige mengder, av de forskjellige kjemiske elementene som utgjør det periodiske bordet. D
Etanamid er et kjemisk stoff som tilhører gruppen organiske nitrogenforbindelser. Den mottar også navnet acetamid, ifølge International Union of Pure and Applied Chemistry (IUPAC for sin akronym på engelsk). Kommersielt kalles det eddiksyreamid. Det kalles amid fordi nitrogenet er festet til en karbonylgruppe. De
Maillard-reaksjonen heter navnet på kjemiske reaksjoner mellom aminosyrer og reduserende sukker som hindrer mat under steking, baking, steking og steking. Brune forbindelser dannes ansvarlig for farge og aroma av produkter som brødskorpen, roastbiff, pommes frites og bakte kaker. Reaksjonen foretrekkes av varmen (temperaturer mellom 140 og 165 ˚C), selv om den også forekommer ved lavere hastighet ved romtemperatur. De
Aluminiumklorid eller aluminiumtriklorid (AlCl 3 ) er et binært salt dannet av aluminium og klor. Noen ganger virker det som et gulpulver fordi det har urenheter på grunn av tilstedeværelsen av jern (III) klorid. Den er oppnådd ved å kombinere dens elementer. Aluminium, som har tre elektroner i sitt siste energinivå (familie IIIA), har en tendens til å gi dem på grunn av dets metalliske karakter. Klor m
Karboksylsyren er et begrep som tilskrives enhver organisk forbindelse som inneholder en karboksylgruppe. De kan også refereres til som organiske syrer, og er til stede i mange naturlige kilder. For eksempel destilleres maursyre, en karboksylsyre, fra maur og andre insekter, slik som billegaleriet. Det vil si, en anthill er en rik kilde til maursyre.
Alendronsyre er en organisk forbindelse som tilhører klassifiseringen av bisfosfonater, spesielt de i andre generasjon; Dette er de som inneholder nitrogenatomer. Denne forbindelse, så vel som resten av bisfosfonater, har en høy strukturell analogi med uorganisk pyrofosfat (PPi). Uorganisk pyrofosfat er produktet av mange syntetiske reaksjoner i kroppen. D
Myresyre eller metansyre Det er den enkleste og minste sammensetningen av alle organiske syrer. Det er også kjent som metansyre og dens molekylformel er HCOOH, med bare ett hydrogenatom bundet til karbonatomet. Navnet stammer fra ordet formica , som på latin betyr ant. Femtende århundre naturalister fant at visse typer insekter (formicidae), som maur, termitter, bier og biller, utskiller denne forbindelsen ansvarlig for sine smertefulle biter. D
Vinsyre er en organisk forbindelse hvis molekylformel er COOH (CHOH) 2COOH. Den har to karboksylgrupper; det vil si, det kan frigjøre to protoner (H +). Med andre ord er det en diprotisk syre. Det kan også klassifiseres som en aldersyre (surt sukker) og et ravsyre-derivat. Dens salt er kjent siden uendelig og er en av biprodukter av vinfremstilling.
Kalsiumklorid (CaCl2 ) Det er et uorganisk salt sammensatt av kalsium, jordalkalimetall og klorhalogen. I den forbindelsen er det flere elektrostatiske interaksjoner som definerer det utvendige utseendet til krystallene og resten av deres fysiske egenskaper. Det er også alltid ledsaget av vannmolekyler, som danner hydrater med generelle formler CaCl2 · xH20, med x = 0, 1, 2, 4 og 6.
Den eksoterme reaksjonen er en type kjemisk reaksjon der en energioverføring oppstår, hovedsakelig i form av utløsning av varme eller lys. Navnet kommer fra det greske prefikset exo , som betyr "til utsiden"; og termen "termisk", som refererer til varme eller temperatur. I denne forstand kan eksoterme reaksjoner overføre andre typer energi til miljøet der de genereres, for eksempel med eksplosjoner og deres måte å overføre kinetisk og sonisk energi når stoffer som er i gassfase ved høye temperaturer, blir utvidet. voldelig
Kjemiske løsninger er det som er kjent som homogene blandinger i kjemi. De er stabile blandinger av to eller flere stoffer der et stoff (kalt et løsemiddel) oppløses i et annet (kalt et løsningsmiddel). Løsningene vedtar løsningen av løsningsmidlet i blandingen og kan eksistere i faste, flytende og gassfaser. I nat
Pyrolysen består av en termisk dekomponeringsprosess hvor stoffene - av organisk opprinnelse i stort flertall - er utsatt for høye temperaturer i et inert medium (uten tilstedeværelse av oksygen). Når organisk materiale behandles ved hjelp av pyrolyse, oppnås produkter som brukes i industriområdet. En a
Termokjemi er ansvarlig for undersøkelsen av de kaloriforandringer som utføres i reaksjonene mellom to eller flere arter. Det regnes som en viktig del av termodynamikken, som studerer omformingen av varme og andre typer energi for å forstå hvilken retning prosesser utvikler og hvordan deres energi varierer. De
Kaliumnitrat er et ternært salt sammensatt av kalium, alkalimetall og oksoanionnitrat. Dens kjemiske formel er KNO 3 , noe som betyr at for hver K + ion er det en NO 3 ion - interaksjon med den. Derfor er det et ionisk salt og utgjør en av alkalititratene (LiNO3, NaNO3, RbNO3 ...). KNO 3 er et sterkt oksidasjonsmiddel på grunn av tilstedeværelsen av nitratanionen. De
Difenylamin er en organisk forbindelse hvis kjemiske formel er (C6H5) 2NH. Navnet tilsier at det er en amin, samt dens formel (-NH 2 ). På den annen side refererer termen "difenyl" til tilstedeværelsen av to aromatiske ringer koblet til nitrogen. Difenylamin er følgelig en aromatisk amin. I
Strontiumklorid er en uorganisk forbindelse dannet av strontium, jordalkalimetall (Mr. Becamgbara) og halogenklorid. Fordi begge elementene har svært forskjellige elektronegativiteter, er forbindelsen et ionisk fast stoff hvis kjemiske formel er SrCl2. Som det er et ionisk fast stoff, består det av ioner.
Fenolftalein er et organisk fargestoff, som igjen er en svak diprotisk syre, som brukes i mange volumetriske bestemmelser som en syre-baseindikator. Det vil si at hvis det er en diprotisk syre, kan det i løsningen miste to H + -ioner, og for å være en indikator må den ha egenskapen å være fargerik i det pH-området som blir evaluert. I gru
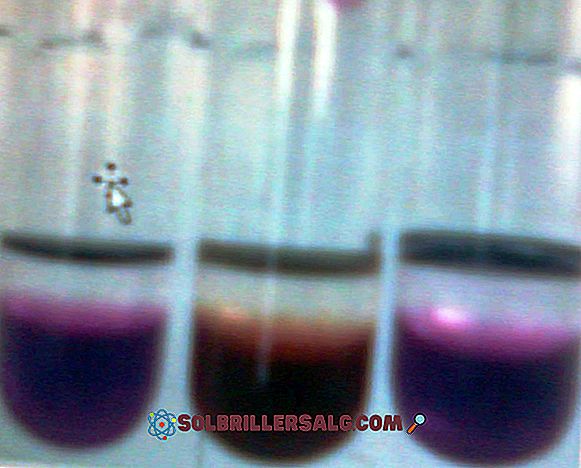
Kaliumpermanganat (KMnO 4) er en uorganisk forbindelse dannet av mangan-overgangsmetallgruppe 7 (VIIB) -, oksygen og kalium. Det er et mørkt lilla glassholdig fast stoff. Deres vandige løsninger er også mørk lilla; Disse løsningene blir mindre fiolette ettersom de er fortynnet i større mengder vann. KMnO
Strontiumoksid , hvis kjemiske formel er SrO (ikke forveksles med strontiumperoksid, som er SrO2), er produktet av den oksidative reaksjon mellom dette metallet og oksygenet i luften ved romtemperatur: 2Sr (s) + O2 (g) → 2SrO (s). Et stykke strontium brenner i kontakt med luften som følge av sin høye reaktivitet, og siden den har en elektronisk konfigurasjon av ns2-typen, gir den lett sine to valenselektroner, spesielt oksygen-diatomisk molekyl. Hv
Differensial- eller differensieringselektronen er den siste elektronen plassert i sekvensen av den elektroniske konfigurasjonen av et atom. Hvorfor heter han? For å svare på dette spørsmålet, er den grunnleggende strukturen til et atom nødvendig: dens kjerne, vakuum og elektroner. Kjernen er et tett, kompakt aggregat av positive partikler kalt protoner, og av nøytrale partikler kalt neutroner. Prot
Hydroksyapatitt er et kalsiumfosfatmineral, hvis kjemiske formel er Ca 10 (PO 4 ) 6 (OH) 2 . Sammen med andre mineraler og organisk materiale forblir knust og komprimert, danner det råstoffet kjent som fosforgjerde. Betegnelsen "hydroksy" refererer til OH-anionen. Hvis i stedet for det anionet var fluor, ville mineralet bli kalt fluoroapatitt (Ca 10 (PO 4 ) 6 (F) 2 , og så med andre anioner (Cl-, Br-, CO 3 2-, etc.)
Magnesiumfosfat er et begrep som refererer til en familie av uorganiske forbindelser dannet av magnesium, jordalkalimetall og oksoanionfosfat. Det enkleste magnesiumfosfatet har kjemisk formel Mg 3 (PO 4 ) 2 . Formelen indikerer at for hver to anioner PO 4 3- er det tre Mg2 + kationer som interagerer med disse
Pyrex glass er et spesielt borosilikatglass hvis merke (Pyrex) viste sitt utseende i New York City i 1915, produsert av Corning Glass. Det oppstod som et materiale for moderne matemballasje, som også brukes til å lagre og bake mat i samme type beholder. Opprinnelsen til ordet Pyrex har generert visse uoverensstemmelser, men det er akseptert at det kommer fra den mest solgte artikkelen i de første øyeblikkene av kommersialiseringen: en tallerken der en kake ble bakt. Me
Enantiomerer er de par organiske (og uorganiske) forbindelser som består av to speilbilder som ikke kan overlappe den ene over den andre. Når motsatt oppstår, for eksempel i tilfelle av en ball, en golfklubb eller en gaffel, sies de å være achirale gjenstander. Begrepet kirurgi ble laget av William Thomson (Lord Kelvin), som definerte at et objekt er chiralt dersom det ikke kan overlappe seg med speilbildet. For
Ikke-jernholdige metaller er alle de som mangler eller har ubetydelige mengder jern. Disse, i forskjellige masseproportioner, brukes til å lage legeringer som har bedre fysiske egenskaper enn enkelte metaller. Dermed er dets krystallinske strukturer og metallinteraksjoner hjørnesteinen i anvendelsen av ikke-jernholdige legeringer.
Nedbør eller kjemisk utfelling er en prosess som består av dannelse av et uoppløselig fast stoff fra blandingen av to homogene løsninger. Til forskjell fra nedbør av regn og snø, i denne typen nedbør "regner det fast" fra overflaten av væsken. I to homogene løsninger oppløses ioner i vann. Når diss
Den metalliske karakteren til elementene i periodisk tabell refererer til alle de kjemiske og fysiske variablene, som definerer metaller eller skiller dem fra andre naturtyper. De er generelt lyse, tette, harde faste stoffer, med høy termisk og elektrisk ledningsevne, formbar og duktil. Imidlertid viser ikke alle metaller slike egenskaper; for eksempel i kvikksølv er dette en lys svart væske. O
Diazoniumsalter er organiske forbindelser der det er ioniske interaksjoner mellom azo-gruppen (-N2 +) og en anion X- (Cl-, F-, CH3COO-, etc.). Den generelle kjemiske formel er RN 2 + X-, og i dette kan sidekjeden R enten være en alifatisk gruppe eller en arylgruppe; det vil si en aromatisk ring. Strukturen av arenodiazoniumion er representert i det nedre bildet.
Jernholdige metaller er de som inneholder jern (Fe), samt små mengder andre metaller som er tilsatt for å gi visse fordelaktige egenskaper til legeringene. Selv om jern kan eksistere i forskjellige oksidasjonstilstander, er +2 (jernholdig) og +3 (ferrisk) den vanligste. Uttrykket "jernholdig" refererer imidlertid til tilstedeværelsen av jern uavhengig av oksidasjonstilstanden i materialet. J
Bandteori er en som definerer den elektroniske strukturen av det faste som helhet. Det kan brukes til alle typer faste stoffer, men det er i metallene der de største suksessene er reflektert. Ifølge denne teorien kommer metallbindingen fra den elektrostatiske tiltrekningen mellom de positivt ladede ionene og de mobile elektronene i krystallet.