kjemi
Alibour vann , også kjent som Agua D'Alibour, er et flytende og lyseblå farmakologisk produkt med en liten lukt av kamfer. Hovedkomponentene er sinksulfat, saffran og kobbersulfat, blandet i vann. Det antas at alibour vann er en god komponent for behandling av hudproblemer som akne og brannsår, så det anses også som en av hovedelementene i hjemmemedisin. Sel
Acaroin , også kjent som "Manchester-væske", "zotal" og "creolina", er et naturlig desinfeksjonsmiddel og baktericid avledet fra destillasjon av tre. Hovedkomponenten er fenol, som skyldes oksydasjon av benzen. Fordi det er en kraftig sammensatt, brukes den hovedsakelig i rensing av næringer, fabrikker, verksteder, dyrehus eller steder der veksten av sopp og bakterier sprer seg. M
Kadmiumhydroksid (Cd (OH) 2 ) er et stoff av uorganisk opprinnelse, karakterisert ved å være i en tilstand av solid aggregering, i form av hvite krystaller. Det er et stoff av ionisk natur med en krystallstruktur av sekskantet type, som utgjør et hydroksyd hvis oppførsel er amfotert. I denne forstand kan kadmiumhydroksid fremstilles på forskjellige måter, for eksempel ved behandling av saltet kjent som kadmiumnitrat med den sterke base natriumhydroksyd. Dett
Fosforsyre er en oksosyre av fosfor som har kjemisk formel H 3 PO 4 . Den består av en mineralsyre der tre syreprotoner er koblet til fosfatanionen (PO 4 3-). Selv om det ikke regnes som en sterk syre, kan den uhensiktsmessige bruken gi en helserisiko. Den finnes i to tilstander: Som et fast stoff i form av tykke ortorhombiske krystaller, eller en krystallinsk væske av sirupaktig utseende.
Krom (Cr) er et metallisk element i gruppe 6 (VIB) i det periodiske bordet. Hvert år produseres tonn av dette metallet ved å ekstrahere kromittmalm eller magnesiummalm (FeCr 2 O 4 , MgCr 2 O 4 ), som reduseres med karbon for å oppnå metallet. Det er veldig reaktivt, og bare i svært reduserende forhold er det i ren form. Nav
Zinkhydroksidet ( Zn (OH) 2) anses som et kjemisk stoff av uorganisk natur, som kun består av tre elementer: sink, hydrogen og oksygen. Det kan finnes på en sjelden måte i naturen, i forskjellige krystallinske faste former av tre mineraler som knapt finnes, kjent som sweetita, ashoverita og wülfingita. Hv
Berylliumhydroksid er en kjemisk forbindelse som består av to molekyler av hydroksid (OH) og et molekyl beryllium (Be). Dens kjemiske formel er Be (OH) 2 og er karakterisert som en amfotert art. Generelt kan det oppnås fra reaksjonen mellom berylliummonoksyd og vann, i henhold til følgende kjemiske reaksjon: BeO + H20 → Be (OH) 2 På den annen side har denne amfotere substansen en molekylær konfigurasjon av lineær type. Imidle
Destillasjonskolben , ballflasken eller destillasjonskulen er en av de mange typer glassbeholdere som brukes i laboratoriet for å utføre destillasjonsprosessen i kjemiske forbindelser som er i væskefasen. På samme måte er utformingen basert på å oppnå best mulig separasjon av prøven som skal analyseres, gi en jevn fordeling av varme, maksimal kontroll over kokingen og en effektiv destillasjon av væsken. På labor
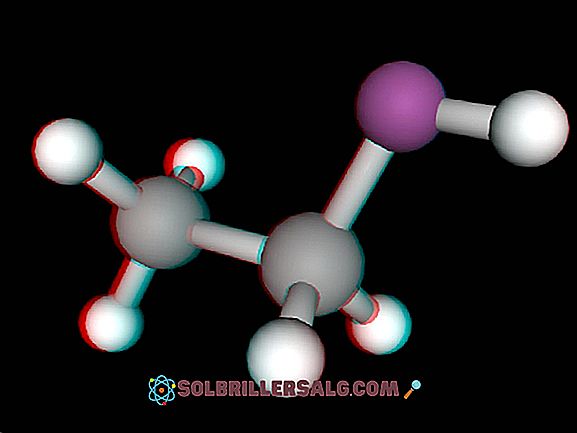
Etan er et enkelt hydrokarbon med formel C 2 H 6 med en fargeløs og luktfri gass natur som har en svært verdifull og variert bruk i syntesen av etylen. I tillegg er det en av de jordbaserte gassene som også er oppdaget i andre planeter og stjernekropper rundt Solsystemet. Det ble oppdaget av forskeren Michael Faraday i år 1834. Bl
Aldehydene er organiske forbindelser som har den generelle formel RCHO. R representerer en alifatisk eller aromatisk; C til karbon; Eller oksygen og H til hydrogen. De er kjennetegnet ved en karbonylgruppe som ketoner og karboksylsyrer, så aldehyder er også referert til som karbonylforbindelser. Karbonylgruppen gir aldehydet mange av dets egenskaper.
Strontiumhydroxid (Sr (OH) 2) er en uorganisk kjemisk forbindelse bestående av en strontiumion (Sr) og to hydroksyd (OH) -ioner. Denne forbindelsen oppnås ved å kombinere et strontiumsalt med en sterk base, hvilket resulterer i en forbindelse av alkalisk natur hvis kjemiske formel er Sr (OH) 2 . Generelt brukes natriumhydroksyd (NaOH) eller kaliumhydroksyd (KOH) som den sterke basen for fremstilling av strontiumhydroksyd. P
En ikke-polar kovalent binding er en type kjemisk binding der to atomer som har tilsvarende elektronegativiteter deler elektroner for å danne et molekyl. Det finnes i et stort antall forbindelser som har forskjellige egenskaper, mellom de to nitrogenatomene som danner gassformige arter (N 2 ) og mellom karbon- og hydrogenatomer som holder sammen metangassmolekylet (CH 4 ), så vel som blant mange andre stoffer.
Klorsyre er en uorganisk forbindelse med formel HClO2. Syren er en av oksidssyrene av klor hvor den er funnet med oksidasjonsstatus 3+. Selv om syren er vanskelig å oppnå i ren substans, er konjugatbasen avledet fra disse syrer, klorittionen, stabil. Et eksempel på et salt av denne anion er den velkjente natriumkloritt. D
Perbromsyre eller tetraoksobromsyre er en uorganisk forbindelse med formel HBrO4. Dens struktur er presentert i Figur 1 (EMBL-EBI, 2007). Det er en bromert oksysyre, der den har en oksidasjonstilstand på 7+. Den er ustabil og kan ikke dannes ved forskyvning av perklorsyreklor, idet perborsyre fremstilles; det kan bare gjøres ved protonering av perbromate ion.
Ammoniumklorid , også kjent som ammoniakkalt, er et uorganisk salt funnet i urin, hvis formel er NH 4 Cl. Det finnes i mineralogiske formasjoner, og i denne formen kalles ammoniakksalt. Det har også blitt funnet i noen vulkanske ventilasjoner og aske. Den kan fås ved hjelp av ulike metoder. Den første er gjennom nøytralisering med HC1 av den ammoniakkalske rest dannet ved destillasjon av karbonet: NH3 + HC1 → NH4Cl. Den a
Kaliumoksid , også kalt dikaliumoksid, er et ionisk oksygen- og kaliumsalt hvis formel er K2O. Dens struktur er presentert i Figur 1 (EMBL-EBI, 2016). K 2 O er det enkleste kaliumoksidet, det er en svært reaktiv og sjelden funnet forbindelse. Noen kommersielle materialer, som gjødsel og sement, testes under antagelse av prosentsatsens sammensetning som ville være ekvivalent med blandingen av kjemiske forbindelser K20. Ka
Hypohydosyre, også kjent som monoksoiodat (I) av hydrogen eller iodol, er en uorganisk forbindelse med formel HIO. Det er et jodoksysyre, med et oksygenatom, et hydrogenatom og et jodatom med en oksidasjonstilstand 1+. Forbindelsen er svært ustabil siden den har en tendens til å gjennomgå en dismutasjonsreaksjon hvor den er redusert til molekylært jod og oksyderes til syre og jod i henhold til reaksjonen: 5HIO → 2I2 + HIO3 + 2H20. Forbi
Zinkoksid er en kjemisk forbindelse av ZnO-formelen. Det er en uorganisk kjemisk forbindelse som brukes som ingrediens i over-the-counter medisiner. Det brukes også hovedsakelig som et additiv i pigmenter og halvledere i ulike bransjer. Sinkoksid finnes i naturen i sinkitt, et mineral som hovedsakelig finnes i New Jersey, USA.
Spansk syre er en mettet kortkjedet fettsyre som omfatter etan festet til karbonet i en karboksygruppe. Formelen er CH3-CH2COOH. Anionen CH3CH2COO- samt salter og estere av propansyre er kjent som propionater (eller propanoater). Den kan oppnås fra rester av vedmasse ved fermenteringsprosess ved bruk av bakterier av slekten propionibacterium .
Kaliumferrocyanid , også kjent som kaliumheksacyanoferrat (II) eller preussisk gul, er en uorganisk forbindelse med formel K4 [Fe (CN) 6 ]. Det er et kaliumsalt av ferrocyanidkoordinasjonskomplekset (Fe (CN) 6 4-) og er vanligvis funnet i den trihydrerte formen K 4 [Fe (CN) 6 ] · H 2 O. Dens struktur er vist på figuren 1 (EMBL-EBI, 2008). H
Hypoklorsyre , også kjent som monoksoklorsyre (I), er en kjemisk forbindelse med formel HClO. Det er et enkelt molekyl med sentral oksygen koblet til klor- og hydrogenatomer gjennom enkle bindinger. Det er en kloroksysyre, som har valens (I). Det er en svak syre som vanligvis dannes når klor oppløses i vann. D
Natriumhydroksid , også kjent som blekemiddel, kaustisk soda eller kaustisk soda, er en kjemisk forbindelse med formel NaOH, som danner en sterkt alkalisk løsning når den oppløses i et løsningsmiddel som vann. Caustic soda er mye brukt i mange bransjer, spesielt som en sterk kjemisk base i produksjon av papirmasse og papir, tekstiler, drikkevann, såper og vaskemidler. Dens
Hydrogensulfid er det vanlige navnet på hydrogensulfid (H 2 S). Det kan betraktes som en hydrazidsyre i løsning (H 2 S (aq)). Betraktningen av sulfhydrylsyre er gitt til tross for den lave oppløseligheten i vann av denne kjemiske forbindelsen. Dens struktur er presentert i Figur 1 (EMBL-EBI, 2005). D
Kaliumsulfat , også kjent som arcanitt, er en kjemisk forbindelse hvis formel er K2SO4. Dens struktur fremgår av figur 1 (EMBL-EBI, 2014). Denne forbindelsen har vært kjent siden begynnelsen av det 14. århundre og ble studert av Glauber, Boyle og Tachenius. I det syttende århundre ble det kalt arcanuni eller salt duplicatum, siden det var en kombinasjon av et surt salt med et alkalisk salt. Det
Sølvkromat er en kjemisk forbindelse med formelen Ag 2 CrO 4 . Det er en av kromforbindelsene i oksidasjonstilstanden (VI) og sies å være forløperen til moderne fotografering. Fremstillingen av forbindelsen er enkel. Dette er produsert ved en utvekslingsreaksjon med et løselig sølvsalt, som det mellom kaliumkromat og sølvnitrat (smrandy1956, 2012). 2AgNO
Karbonsyre , tidligere kalt luft syre eller luft syre, er den eneste uorganiske syren i karbon og har formelen H2CO3. Saltene av karbonsyrer kalles bikarbonater (eller hydrogenkarbonater) og karbonater (Human Metabolome Database, 2017). Dens struktur er presentert i figur 1 (EMBL-EBI, 2016). Det sies at karbonsyre dannes av karbondioksid og vann
Natriumtiosulfat eller natriumhyposulfitt (Na2S203 ) er et viktig uorganisk salt med ulike medisinske anvendelser. Den er også tilgjengelig som sitt pentahydratsalt (Na2S203.5H20). Det er en ionisk forbindelse dannet av to natriumkationer (Na +) og negativt ladet tiosulfatanion (S203-), hvor det sentrale svovelatomet er bundet til tre oksygenatomer og et annet svovelatom (derfor prefiks onkel), gjennom enkle og doble koblinger med resonans karakter.
Kaliumkromat er en uorganisk forbindelse med formel K 2 CrO 4 , som er karakterisert som et kraftig oksidasjonsmiddel. Den fremstilles ved å behandle kaliumdikromat med kaliumhydroksyd i henhold til reaksjonen: K 2 CrO 7 + 2KOH → 2K 2 CrO 4 + H 2 O. Som en forbindelse med en relativt unik profil har kaliumkromat et antall bruksområder i industrielle og vitenskapelige sammenhenger. På
Ammoniumionet er en positivt ladet polyatomisk kation hvis kjemiske formel er NH4 +. Molekylet er ikke flatt, men har formen av en tetraeder. De fire hydrogenatomer utgjør de fire hjørnene. Ammoniakkens nitrogen har et par ikke-delte elektroner som er i stand til å akseptere en proton (Lewis-base), derfor blir ammoniumionen dannet ved protonering av ammoniakken i henhold til reaksjonen: NH3 + H + → NH4 + Ammonium er også substituert substituerte aminer eller substituerte ammoniumkationer. For
Pyruvinsyre er en 2-okso-monokarboksylsyre som er 2-keto-derivatet av propionsyre. Formelen er CH3COCOOH. Det er den enkleste av alfa-keto syrer, med en karboksylsyre og en keton funksjonell gruppe. Dens struktur er presentert i figur 1 (EMBL-EBI, 2017). Pyruvat, konjugatbasen (CH3COCOO-) er et sentralt mellomprodukt i metabolismen av karbohydrater, proteiner og fettstoffer