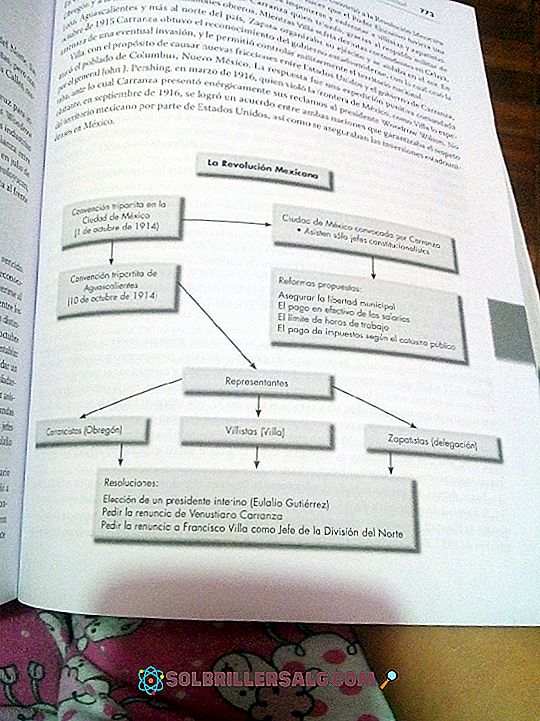
Nøytraliseringsreaksjon: Egenskaper, Produkter og Eksempler
En nøytraliseringsreaksjon er en som oppstår mellom en syre og en grunnart på en kvantitativ måte. Generelt, i denne type reaksjoner i vandig medium produseres vann og et salt (ioniske arter sammensatt av en kation annet enn H + og en anion forskjellig fra OH- eller O2-) i henhold til følgende ligning: syre + base → salt + vann.
I en nøytraliseringsreaksjon er det involvert elektrolytter, som er stoffer som, når de er oppløst i vann, genererer en løsning som tillater elektrisk ledningsevne. Syrer, baser og salter betraktes som elektrolytter.

På denne måten er sterke elektrolytter de arter som dissocierer helt i deres bestandige ioner når de er i løsning, mens svake elektrolytter kun delvis er ionisert (de har mindre kapasitet til å utføre en elektrisk strøm, det vil si at de ikke er gode ledere som sterke elektrolytter).
funksjoner
For det første må det understrekes at dersom en nøytraliseringsreaksjon initieres med like mengder av syren og basen (i mol), når reaksjonen utløper, oppnås bare ett salt; det vil si, det er ingen resterende mengder syre eller base.
I tillegg er en svært viktig egenskap av syrebasereaksjoner pH, noe som indikerer hvor sur eller grunnleggende en løsning er. Dette bestemmes av mengden av H + -ioner som er funnet i oppløste oppløsninger.
På den annen side er det flere konsepter av surhet og basicitet avhengig av parametrene som tas i betraktning. Et konsept som skiller seg ut er at Brønsted og Lowry, som anser en syre som en art som er i stand til å donere protoner (H +) og en base som arten som er i stand til å akseptere dem.
Syre-base titreringer
For å riktig og kvantitativt studere en nøytraliseringsreaksjon mellom en syre og en base, påføres en teknikk som kalles syrebasertitrering (eller titrering).
Syre-base titreringer består i å bestemme konsentrasjonen av syre eller base som er nødvendig for å nøytralisere en viss mengde base eller syre med kjent konsentrasjon.
I praksis skal en standardløsning (hvis konsentrasjon er kjent nøyaktig) tilsettes gradvis til løsningen hvis konsentrasjon er ukjent inntil ekvivalenspunktet er nådd, hvor en av artene har fullstendig nøytralisert den andre.
Punktet for ekvivalens oppdages ved voldelig endring av fargen på indikatoren som er blitt tilsatt til løsningen av ukjent konsentrasjon når kjemisk reaksjon mellom begge løsningene er fullført.
For eksempel, når det gjelder nøytralisering av fosforsyre (H3PO4), vil det være et ekvivalenspunkt for hver proton som løsner fra syren; det vil si tre ekvivalenspunkter, og tre fargeendringer vil bli observert.
Produkter av en nøytraliseringsreaksjon
I reaksjonene av en sterk syre med en sterk base utføres fullstendig nøytralisering av arten, som i reaksjonen mellom saltsyre og bariumhydroksyd:
2HCl (aq) + Ba (OH) 2 (ac) → BaCl2 (ac) + 2H20 (l)
Således genereres ikke overskytende H + eller OH-ioner, noe som betyr at pH-verdien til de sterke elektrolytløsninger som er nøytralisert, er iboende relatert til syreegenskapen til deres reaktanter.
Tvert imot, når det gjelder nøytralisering mellom en svak elektrolytt og en sterk elektrolytt (sterk syre + svak base eller svak syre + sterk base), oppnås partiell dissosiasjon av den svake elektrolytt og dissociasjonskonstanten av syren fremkommer (K a ) eller fra basen (Kb) svak, for å bestemme syre eller grunnleggende karakter av nettreaksjonen ved å beregne pH.
For eksempel har du reaksjonen mellom hydrocyansyre og natriumhydroksyd:
HCN (ac) + NaOH (ac) → NaCN (ac) + H20 (l)
I denne reaksjonen ioniserer den svake elektrolytten ikke signifikant i løsningen, slik at netto ionisk ligning er representert som følger:
HCN (ac) + OH- (ac) → CN- (ac) + H20 (l)
Dette oppnås etter at reaksjonen er skrevet med de sterke elektrolytter i dissociert form (Na + (ac) + OH- (ac) på siden av reaktantene, og Na + (ac) + CN- (ac) på siden av produkter), hvor bare natriumion er en tilskuer.
Til slutt, når det gjelder reaksjonen mellom en svak syre og en svak base, oppstår nevnte nøytralisering ikke. Dette skyldes at begge elektrolyttene dissocierer delvis, uten at det resulterer i forventet vann og salt.
eksempler
Sterk syre + sterk base
Den gitte reaksjon mellom svovelsyre og kaliumhydroksyd i et vandig medium tas som et eksempel i henhold til følgende ligning:
H2SO4 (ac) + 2KOH (ac) → K2SO4 (ac) + 2H20 (l)
Det kan ses at både syre og hydroksid er sterke elektrolytter; Derfor er de helt ionisert i løsningen. PH av denne løsningen vil avhenge av den sterke elektrolytten som er i større grad.

Sterk syre + svak base
Nøytraliseringen av salpetersyre med ammoniakk resulterer i ammoniumnitratforbindelsen, som vist nedenfor:
HNO3 (ac) + NH3 (ac) → NH4NO3 (ac)
I dette tilfellet blir ikke vannet produsert sammen med saltet observert, fordi det måtte være representert som:
HNO3 (ac) + NH4 + (ac) + OH- (ac) → NH4NO3 (ac) + H20 (l)
Så vann kan bli observert som et produkt av reaksjonen. I dette tilfellet vil løsningen ha en hovedsakelig sur pH.
Svak syre + sterk base
Deretter vises reaksjonen mellom eddiksyre og natriumhydroksyd:
CH3COOH (ac) + NaOH (ac) → CH3COONa (ac) + H20 (l)
Da eddiksyre er en svak elektrolytt, dissosieres det delvis, noe som resulterer i natriumacetat og vann, hvis oppløsning vil ha en basisk pH.
Svak syre + svak base
Endelig og som nevnt ovenfor, kan en svak base ikke nøytralisere en svak syre; Det motsatte skjer heller ikke. Begge arter hydrolyseres i vandig oppløsning, og oppløsningens pH vil avhenge av "styrken" av syre og base.