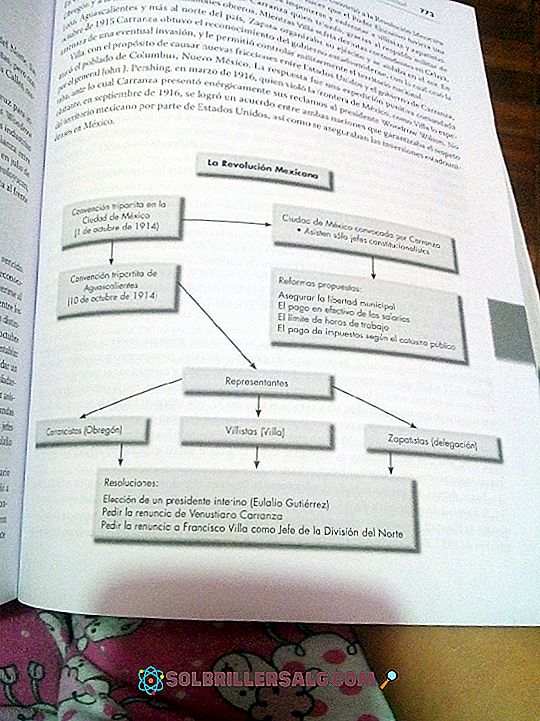
De 6 faktorene som påvirker hovedoppløseligheten
De viktigste faktorene som påvirker oppløseligheten er polariteten, virkningen av felles ion, temperaturen, trykket, løsningsmidlets natur og de mekaniske faktorene.

Oppløseligheten av et stoff avhenger hovedsakelig av det anvendte løsningsmidlet, samt på temperatur og trykk. Løseligheten av et stoff i et bestemt løsningsmiddel måles ved konsentrasjonen av den mettede løsningen.
En løsning betraktes som mettet når tilsetningen av ytterligere løsemiddel ikke lenger øker konsentrasjonen av oppløsningen.
Graden av oppløselighet varierer mye, avhengig av stoffene, fra uendelig løselig (helt blandbar), som etanol i vann, til dårlig oppløselig, slik som sølvklorid i vann. Uttrykket "uoppløselig" brukes ofte på dårlig oppløselige forbindelser (Boundless, SF).
Visse substanser er oppløselige i alle forhold med et gitt løsningsmiddel, som etanol i vann, denne egenskapen er kjent som blandbarhet.
Under forskjellige forhold kan likevektsløseligheten overvinnes for å gi en løsning som kalles overmettet (Løselighet, SF).
Hovedfaktorer som påvirker oppløseligheten
1- Polaritet
I de fleste tilfeller oppløses oppløsningsmidlene i løsningsmidler som har en lignende polaritet. Kjemikere bruker en populær avorisme for å beskrive denne egenskapen av løsemidler og løsningsmidler: "Lignende oppløses som".
Ikke-polare oppløsninger oppløses ikke i polare løsemidler og vice versa (Utdanning online, SF).
2- Effekt av vanlig ion
Den generelle ion-effekten er et begrep som beskriver reduksjonen i oppløseligheten av en ionisk forbindelse når et salt som inneholder en ion som allerede eksisterer i kjemisk likevekt, blir tilsatt til blandingen.
Denne effekten er best forklart av Le Châteliers prinsipp. Tenk deg om det litt oppløselige ioniske kalsiumforbindelsessulfatet, CaSO4, blir tilsatt til vann. Netto ionisk ligning for den resulterende kjemiske likevekt er som følger:
CaSO4 (s) ⇌Ca2 + (aq) + SO42- (aq)
Kalsiumsulfat er litt løselig. I likevekt finnes det meste av kalsium og sulfat i fast form av kalsiumsulfat.
La oss anta at det løselige ionforbindelsen kobbersulfat (CuSO 4 ) ble tilsatt til løsningen. Kobbersulfat er oppløselig; Derfor er den eneste viktige effekten i netto ionekvasjonen tilsetningen av flere sulfationer (SO 4 2-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42- (aq)
Dissocierte sulfat-kobbersulfationer er allerede tilstede (vanlige) i blandingen fra den lette dissosiasjon av kalsiumsulfat.
Derfor understreker denne tilsetningen av sulfationer den likevekt som tidligere ble etablert.
Prinsippet av Le Chatelier dikterer at den ekstra innsatsen på denne siden av likevektsproduktet resulterer i endring av likevekt mot siden av reaktantene for å lette denne nye spenningen.
På grunn av endringen mot reaktantsiden reduseres løseligheten av det lite oppløselige kalsiumsulfatet ytterligere (Erica Tran, 2016).
3- Temperatur
Temperaturen har en direkte effekt på oppløseligheten. For de fleste ioniske faste stoffer øker temperaturen den hastigheten som løsningen kan gjøres på.
Når temperaturen øker, beveger partiklene av det faste stoffet seg raskere, noe som øker sjansene for at de interagerer med flere partikler av løsningsmidlet. Dette resulterer i økningen i hastigheten der en løsning oppstår.
Temperaturen kan også øke mengden løsemiddel som kan oppløses i et løsningsmiddel. Generelt sett, etter hvert som temperaturen øker, oppløser flere oppløste partikler.
For eksempel, når bordsukker er tilsatt til vann, er det en enkel metode for å lage en løsning. Når denne løsningen oppvarmes og sukker fortsetter å bli tilsatt, er det funnet at store mengder sukker kan tilsettes ettersom temperaturen fortsetter å stige.
Årsaken til dette er at når temperaturen øker, kan de intermolekylære kreftene bryte ned lettere, slik at flere oppløste partikler blir tiltrukket av løsningsmiddelpartiklene.
Det er andre eksempler, men hvor økningen i temperatur har svært liten effekt på mengden løsemiddel kan løses.
Bordsalt er et godt eksempel: du kan oppløse nesten samme mengde bordsalt i isvann som du kan i kokende vann.
For alle gasser, etter hvert som temperaturen øker, reduseres oppløseligheten. Den kinetiske molekylærteori kan brukes til å forklare dette fenomenet.
Etter hvert som temperaturen øker, beveger gassmolekylene seg raskere og kan flykte fra væsken. Løseligheten av gassen senker deretter.

Når man ser på den følgende grafen, viser ammoniakkgassen, NH3, en sterk reduksjon i oppløseligheten etter hvert som temperaturen øker, mens alle ioniske faste stoffer viser en økning i oppløseligheten etter hvert som temperaturen øker (CK-12 Foundation, SF) .
4-trykk
Den andre faktor, trykk, påvirker oppløseligheten av en gass i en væske, men aldri et fast stoff som oppløses i en væske.
Når trykk påføres en gass som er over overflaten av et løsningsmiddel, vil gassen bevege seg til løsningsmidlet og oppta noen av mellomrommene mellom løsningsmiddelpartiklene.
Et godt eksempel er karbonert brus. Trykket påføres for å tvinge CO2-molekylene i brusen. Det motsatte er også sant. Når gasstrykket minker, reduseres også denne gassens løselighet.
Når en boks med karbonert drikke åpnes, senkes trykket i bruset, slik at gassen umiddelbart begynner å komme ut av løsningen.
Karbondioksidet som er lagret i soda, frigjøres, og du kan se bruddet på overflaten av væsken. Hvis du forlater en åpen brus med en periode, kan du merke at drikken blir flat på grunn av tap av karbondioksid.
Denne gass-trykkfaktoren er uttrykt i Henrys lov. Henrys lov sier at ved en gitt temperatur er løseligheten av en gass i en væske proporsjonal med gassens partialtrykk på væsken.
Et eksempel på Henrys lov forekommer i dykking. Når en person nedsenker seg i dypt vann, øker trykket og flere gasser oppløses i blodet.
Mens du klatrer fra et dykk i dypt vann, trenger dykkeren å gå tilbake til vannet i svært langsom fart for å la alle oppløste gasser forlate blodet veldig sakte.
Hvis en person stiger for fort, kan det oppstå en medisinsk nødsituasjon på grunn av gassene som gir blodet for fort (Papapodcasts, 2010).
5- Oppløsningsart
Oppløsningenes natur og løsningsmiddelet og tilstedeværelsen av andre kjemiske forbindelser i løsningen påvirker oppløseligheten.
For eksempel kan du oppløse en større mengde sukker i vann enn salt i vann. I dette tilfellet sies det at sukker er mer løselig.
Etanol i vann er fullstendig løselig med hverandre. I dette spesielle tilfellet vil løsningsmidlet være forbindelsen som er i større mengde.
Størrelsen på løsemiddelet er også en viktig faktor. Jo større løsningsmolekylene, desto større er deres molekylvekt og størrelse. Det er vanskeligere for løsningsmiddelmolekyler å omgjøre større molekyler.
Hvis alle de nevnte faktorene er utelukket, kan en generell regel oppdages at de større partiklene generelt er mindre oppløselige.
Hvis trykket og temperaturen er det samme som mellom to oppløsninger av samme polaritet, er den med mindre partikler vanligvis mer løselig (Faktorer som påvirker oppløselighet, SF).
6- Mekaniske faktorer
I motsetning til oppløsningshastigheten, som hovedsakelig avhenger av temperatur, avhenger omkrystallisasjonshastigheten av konsentrasjonen av oppløsningsmiddel på overflaten av krystallgitteret, som foretrekkes når en oppløsning er immobile.
Derfor unngår oppløsningen av løsningen denne akkumuleringen, maksimerer oppløsning. (typer metning, 2014).